В цитогенетике млекопитающих последние годы ознаменованы стремительным развитием новых методов исследований, в основе которых лежит флуоресцентная in situ гибридизация нуклеиновых кислот. Десять-пятнадцать лет назад возможности исследователя были практически сведены к изучению морфологии и дифференциальной окрашиваемости хромосом и их отдельных районов. Развитие методов, способных на цитологических препаратах визуализировать интересующие последовательности ДНК, резко изменило ситуацию. Метод флуоресцентной in situ гибридизации (FISH) оказался крайне эффективным инструментом изучения генома человека и других видов млекопитающих, реорганизации хромосом в ходе эволюции, анализа хромосомных перестроек как при малигнизации клеток, так и при врожденных патологиях. С его помощью были получены оригинальные данные по организации интерфазного ядра. Возник новый раздел цитогенетики – интерфазная цитогенетика. В настоящее время редкое исследование, требующее анализа хромосом, обходится без использования FISH. Гибридизация in situ дала начало огромному числу методических разработок, которые уже нашли широкое применение в практической медицине, а современная хромосомная диагностика продвинулась значительно дальше самых смелых фантазий цитологов 80-х годов.
Если еще сравнительно недавно цитогенетики вынуждены были пользоваться преимущественно гаптен-мечеными ДНК пробами (например: биотин, дигоксигенин), то появление новых более эффективных флуорохромов позволило перейти к ДНК пробам, меченным флуорохромами. Это сделало возможным анализ результатов FISH непосредственно после отмывок без каких-либо специальных процедур, предназначенных для визуализации меченой пробы. Значительную роль в развитии новых вариантов FISH сыграл приход новых методов регистрации микроскопических изображений. Замена фотонасадок CCD-камерами (CCD-камерами с высоким уровнем разрешения, охлаждаемыми CCD-камерами с длительным временем накопления сигнала и т.д.) с соответствующим компьютерным обеспечением не просто упростила и ускорила процесс регистрации микроскопических изображений, но и предоставила экспериментатору принципиально новые возможности обработки изображений, записанных в цифровом формате. Новая приборная база позволила осуществлять регистрацию сверхслабых световых сигналов, недоступных глазу человека, а также световых сигналов с длинами волн, выходящими за пределы видимого света.
Одним из следствий стремительного прогресса в развитии методической базы хромосомного анализа явилось отсутствие серьезных работ, в которых бы были подробно рассмотрены тенденции развития современной цитогенетики, история ее развития и возможности новых методов. В настоящей статье мы также ограничимся лишь кратким описанием одного из направлений ее развития – многоцветной флуоресцентной in situ гибридизацией. Надеюсь, что настоящая статья поможет широкому кругу биологов хотя бы поверхностно познакомится с некоторыми новыми возможностями проведения хромосомного анализа.
Таблица
Комбинации фильтров фирмы ZEISS для флуоресцентной микроскопии
Флуорохромы |
Фильтр возбуждения |
Дихронное зеркало |
Запирающий фильтр |
| DAPI, AMCA, Hoechst | BP365/12 |
FT 395 |
LP 397 |
| Chromomycin | BP395-440 |
FT 460 |
LP470 |
| Propidium iodide (PI) | BP546/12 |
FT 580 |
LP590 |
| FITC/PI | BP450-490 |
FT510 |
LP520 |
| FITC | BP450-490 |
FT510 |
BP515-565 |
| Cyanin 2 | BP450-490 |
FT510 |
LP520 |
| Rhodamin, TRITC | BP546/12 |
FT580 |
LP590 |
| Texas-Red | BP530-585 |
FT600 |
LP615 |
| Cyanin 3 | BP546/12 |
FT560 |
BP575-640 |
| Cyanin 5 | BP575-625 |
FT645 |
BP660-710 |
| Cyanin 7 | BP710/75 |
FT750 |
BP810/90 |
Двухполосные фильтры фирмы ZEISS* |
|||
| DAPI/FITC | DBP410/16 и 489/22 |
FT440/505 |
DBP456/17 и 535/44 |
| DAPI/TRITC | DBP406/23 и 530/45 |
FT435/570 |
DBP467/30 и 618/75 |
| FITC/TRITC | DBP485/20 и 546/12 |
FT500/560 |
DBP515-530 и 580-630 |
| FITC/Texas-Red | DBP485/20 и 578/14 |
FT500/600 |
BP 515-540 и LP610 |
Трехполосные фильтры фирмы ZEISS* |
|||
| DAPI/FITC/TRITC/Texas-Red | TBP 400/495/570 | FT410/505/585 |
TBP 460/530/610 |
Фильтры Пинкеля фирмы ZEISS** |
|||
| DAPI/FITC/TRITC/Texas-Red | BP 365/12 BP 450-490 BP 546/12 BP 530-585 |
FT405/495/575 |
|
** Фильтры для регистрации многоцветной флуоресценции с точной регистрацией пикселов.
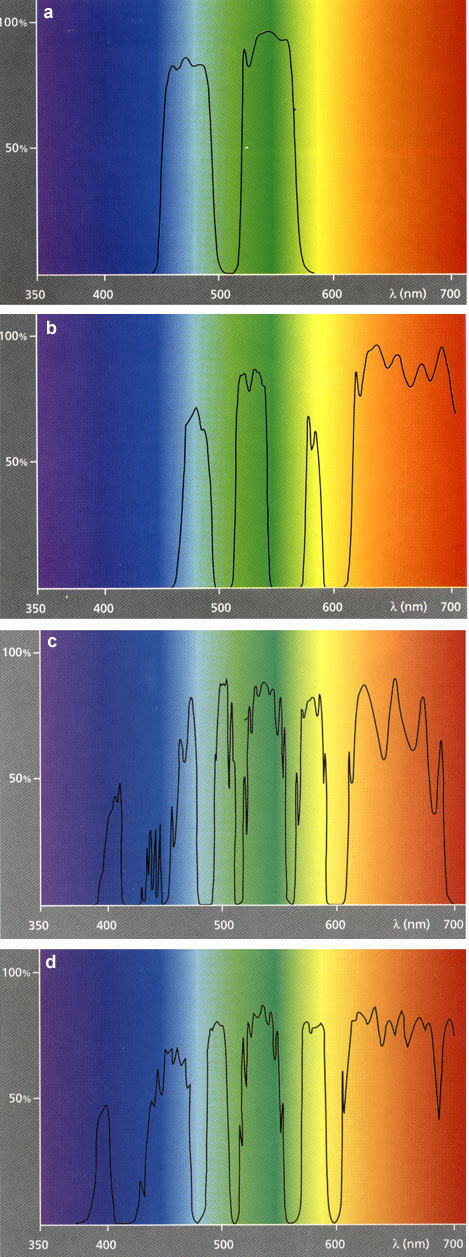
Современная техника регистрации сигнала способна регистрировать не только его интенсивность, но и спектральные характеристики. Такое приборное оснащение лежит в основе спектрального кариотипирования (SKY). Однако в настоящее время для получения многоцветных изображений FISH вполне достаточно обычной черно-белой цифровой регистрации сигнала. Информация об интенсивности свечения каждого из флуорохромов записывается отдельно благодаря специфичной комбинации возбуждающего и запирающего фильтров. При этом каждому из таких изображений присваивается свой собственный уникальный псевдоцвет. Очевидно, что такая система регистрации при наличии необходимых фильтров позволяет в одном эксперименте использовать любые флуорохромы с неперекрывающимися спектрами эмиссии или возбуждения. Характеристики некоторых фильтров, широко используемых в современной цитогенетике, приведены в таблице и на рисунке 1.
Следует заметить, что одновременное использование n флуорохромов позволяет получить значительно большее число псевдоцветов. Пусть точка, окрашенная флуорохромом a будет считаться точкой псевдоцвета № 1, точка, окрашенная флуорохромом b будет считаться точкой псевдоцвета № 2, в этом случае можно принять, что точка, окрашенная флуорохромами а и b одновременно, будет считаться точкой псевдоцвета № 3. Таким образом, использование двух флуорохромов позволяет пометить и анализировать в FISH одновременно 3 пробы ДНК, получая четырехцветное изображение (третий флуорохром используется для общей окраски хромосом). В этом эксперименте одна из проб должна быть помечена и флуорохромом a, и флуорохромом b. На рисунке 2 показана визуализация трех хромосом норки в одном эксперименте с использованием двух флуорохромов для мечения хромосомспецифичных ДНК проб. Очевидно, что использование n флуорохромов позволяет одновременно анализировать 2n-1 ДНК проб. То есть уже 5 флуорохромов делают возможным анализ результатов одновременной гибридизации 31 пробы ДНК.
Кариотип человека состоит из 22 аутосом и половых хромосом X и Y. То есть для одновременной идентификации материала всех хромосом человека необходимо иметь 24 уникально меченые хромосомспецифичные ДНК пробы. Для их мечения вполне достаточно 5 флуорохромов. Хромосомспецифические ДНК библиотеки метятся уникальными комбинациями трех флуорохромов. В результате флуоресцентной in situ гибридизации каждой хромосоме человека соответствует свой псевдоцвет (рис. 3). Такой метод хромосомного анализа позволяет выявлять и идентифицировать любые транслокации материала негомологичных хромосом. Окраска хромосомы более чем одним цветом свидетельствует о наличии транслокации. Цвет хромосомных районов позволяет однозначно определить хромосомы, которые были вовлечены в данные хромосомные перестройки (рис. 4). Более того, одновременное получение дифференциальной исчерченности анализируемых хромосом нередко позволяет провести и идентификацию точек разрывов-воссоединений, имевших место при хромосомных перестройках. Благодаря 24-цветной FISH первичный анализ сложных кариотипов может быть завершен менее чем за двое суток. При этом полученные результаты будут абсолютно достоверны. Только в самых сложных случаях могут потребоваться дополнительные исследования для уточнения положения точек разрывов-воссоединений. К сожалению, необходимо отметить, что 24-цветная FISH оказывается бесполезной при анализе внутрихромосомных перестроек. Делеции, инверсии, дупликации остаются невидимыми для этого метода.
В 1997 г. группа исследователей из Кэмбриджского университета под руководством профессора Малкольма Фергюсона-Смита, докторов Иоганнеса Виенберга и Стефана Мюллера разработала базу для метода многоцветного бэндинга хромосом человека. В основе этого метода, получившего название RXFISH, лежит тот же принцип многоцветной in situ гибридизации, но в отличие от 24-цветной FISH, этот метод позволяет выявлять и часть внутрихромосомных перестроек. ДНК пробы, используемые в RXFISH, помечены комбинацией трех флуорохромов, что обеспечивает 7 псевдоцветов. Однако они специфично окрашивают отдельные районы хромосом, создавая их цветную исчерченность. Правда, все пробы окрашивают несколько хромосомных районов разных хромосом. Такая особенность ДНК проб для RXFISH обусловлена способом их получения. Они представляют собой хромосомспецифичные ДНК библиотеки двух видов гиббонов: Hylobates concolor и Hylobates syndactylus. В результате интенсивных хромосомных перестроек, имевших место при формировании современных видов гиббонов, материал их хромосом оказался сильно перетасованным в сравнении с организацией хромосом у их общего предка, а также у человека, хромосомы которого известны своим консерватизмом. Отношение хромосомы 1 человека к хромосомам гиббонов приведено на рисунке 4, а на рисунке 5 приведен общий вид хромосом человека, полученный в результате RXFISH. Очевидно, что, несмотря на всю фантастичность картины RXFISH, использование этого метода имеет достаточно серьезные ограничения: перестройки хромосом, имевшие место внутри одного цветного RX-бэнда, не могут быть выявлены с помощью этого метода, если они не приводят к значительным и легко видимым изменениям размера этого бэнда. Тем не менее, следует признать, что RXFISH при увеличении числа используемых флуорохромов, несомненно, будет более информативным, чем рутинная 24-цветная FISH. Интересной методической особенностью RXFISH является возможность ее проведения без супрессии гибридизации меченых повторенных последовательностей предгибридизацией с Cot1 ДНК человека. Авторы полагают, что это оказалось возможным благодаря различию первичных последовательностей диспергированных повторов гиббонов и человека. Стоит, однако, заметить, что одновременное использование ДНК проб, меченных 3 различными флуорохромами, должно приводить к 3-кратному ослаблению сигнала, обусловленного диспергированными повторами.
В настоящее время совместно с фирмой “Applied Imaging” авторы метода превратили его в рутинную процедуру, создав коммерчески доступный KIT и необходимое программное обеспечение. К достоинствам RXFISH в настоящее время, несомненно, следует отнести следующие пункты:
К недостаткам RXFISH можно отнести большой размер многих цветных бэндов. А такие хромосомы человека, как 15, 18, 19, 21, 22, X и Y представляют собой один цветной бэнд каждая. Использование в будущем большего числа флуорохромов и новых ДНК проб, полученных благодаря использованию искусственных хромосом или микродиссекции метафазных хромосом, может значительно повысить разрешающие способности метода. С новостями RXFISH читатель может ознакомится на WEBSITE фирмы “Applied Imaging” (http://www.aii.co.uk/).
Одновременно с RXFISH была предложена еще одна система получения многоцветного бэндинга хромосом человека. В отличие от RXFISH, она предназначена не для полного анализа всех хромосом, а для проведения детального анализа одной из них. Данная система была разработана сотрудниками Института генетики человека университета города Йены (профессор Уве Клауссен, доктор Ильза Худоба) в сотрудничестве с фирмой MetaSystems. В этих целях был получен комплект микродиссекционных ДНК проб и разработано специальное программное обеспечение “MetaSystems’ isis mFISH” для сравнительного анализа уровня свечения различных флуорохромов. Районспецифичные ДНК пробы были помечены различными флуорохромами или комбинациями флуорохромов. Уровень сигнала каждой из микродиссекционных районспецифических библиотек варьирует по интенсивности, достигая максимума в центре и постепенно падая практически до нуля на его границах. Перекрывание профилей интенсивности сигналов ДНК проб обеспечивает вариации соотношений интенсивностей флуоресценций различных флуорохромов вдоль хромосомы. Отношения интенсивностей может быть переведено в термины псевдоцвета, и таким образом, каждой точке изображения приписан свой псевдоцвет. В результате программной обработки изображения каждому из хромосомных районов будет соответствовать свой псевдоцвет. Необходимое программное обеспечение входит в пакет программ фирмы MetaSystems GmbH. Наглядным примером использования данного подхода может служить цветной бэндинг хромосомы 5 человека. Семь районспецифичных микродиссекционных ДНК проб были помечены 5 различными флуорохромами (рис. 6). Профили интенсивности сигналов ДНК проб представлены на рисунке 6. Компьютерная обработка соотношений интенсивности свечения флуорохромов выделила более 20 бэндов различных псевдоцветов. Причем, это число бэндов выявляется даже на коротких, сильно конденсированных хромосомах, что открывает возможности проведения высокоразрешающего хромосомного анализа при окрашивании хромосом поздней метафазы (рис. 7). Данный вариант многоцветной FISH оказался высокоэффективным при анализе не только межхромосомных, но и внутрихромосомных перестроек. Правда, для успешного его применения исследователь должен предварительно определить хромосому, в детальном изучении которой он заинтересован. С новыми разработками фирмы MetaSystems GmbH читатель может познакомиться на WEBSITE http://www.metasystems.de.
Уже в настоящее время в ряде диагностических центров некоторые варианты многоцветной FISH используются в качестве рутинных методик при анализе хромосомных перестроек у человека. Наиболее широкое применение они находят при анализе реорганизации генома трансформированных клеток в случаях онкологических заболеваний. Крайне перспективным представляется их использование при изучении организации интерфазного ядра и пространственной организации хромосом в ходе клеточного цикла. Дальнейшее совершенствование методов многоцветной FISH и их совместное использование с конфокальной микроскопией может открыть принципиально новые возможности в цитологических исследованиях, а полученные с их помощью результаты могут привести к революции в наших взглядах на морфофункциональную организацию клетки.

Рис. 1. Спектральные характеристики некоторых фильтров, широко используемых в FISH.
a – комплект однополосных фильтров; b – комплект двухполосных фильтров; c – комплект трехполосных фильтров; d – комплект фильтров в соответствии с классификацией проф. Пинкеля.
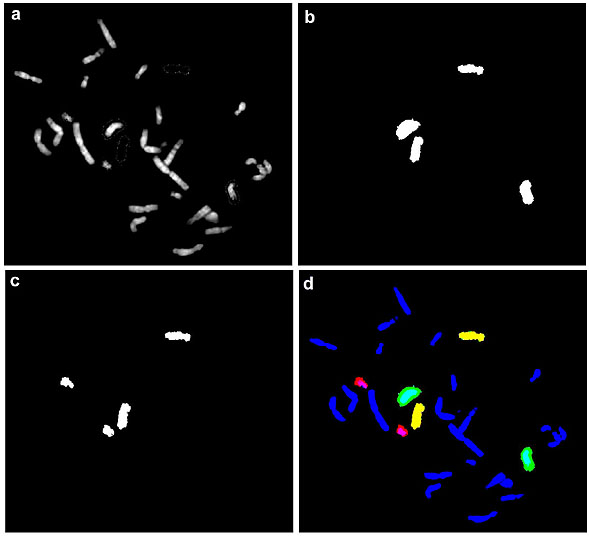
Рис. 2. Детекция 3 пар хромосом американской норки в 3-цветной FISH с двумя флуорохромами.
a – DAPI; b – FITC – хромосомный пэйнтинг биотин-мечеными микродиссекционными ДНК библиотеками 9-й и 10-й хромосом норки; c – Cy3 – хромосомный пэйнтинг дигоксигенин-мечеными микродиссекционными ДНК библиотеками 9-й и 13-й хромосом норки; d – псевдоцвет №1 – FITC, псевдоцвет №2 - Cy3, псевдоцвет №3 – FITC + Cy3.
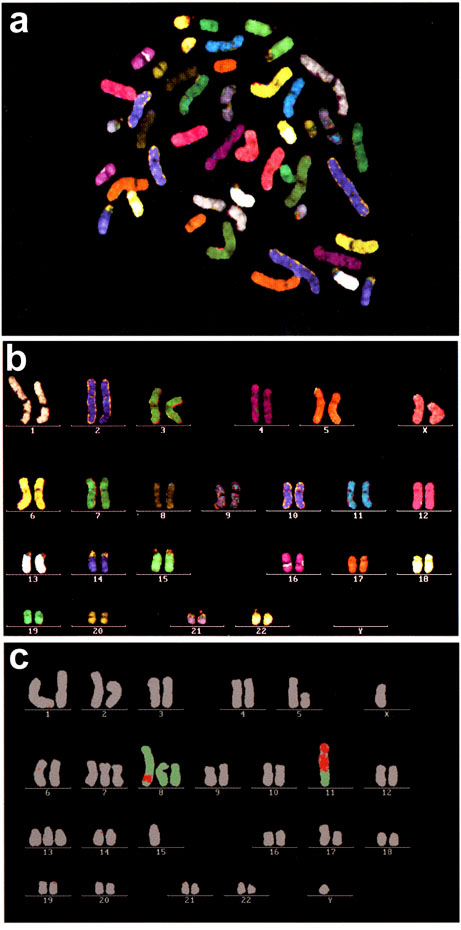
Рис. 3. 24-цветная FISH хромосом человека.
a – метафазная пластинка; b – pаскладка хромосом; с – aнализ транслокации 8-й и 11-й хромосом человека.
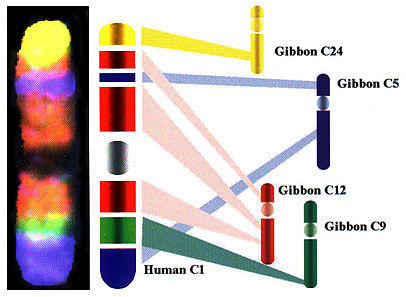
Рис. 4. Природа цветной исчерченности хромосомы 1 человека при RXFISH.
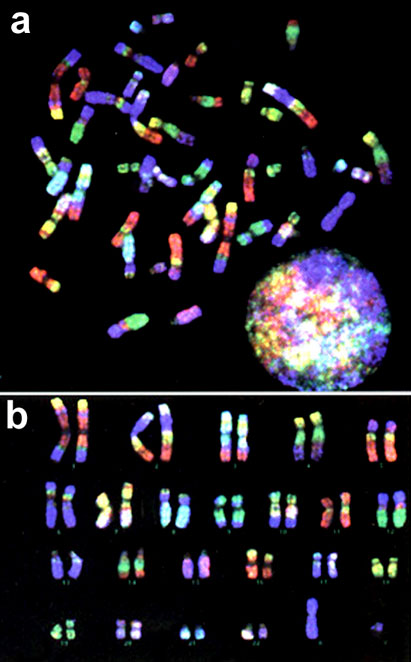
Рис. 5. Цветная исчерченность хромосом человека при RXFISH.
a – метафазная пластинка; b – pаскладка хромосом.
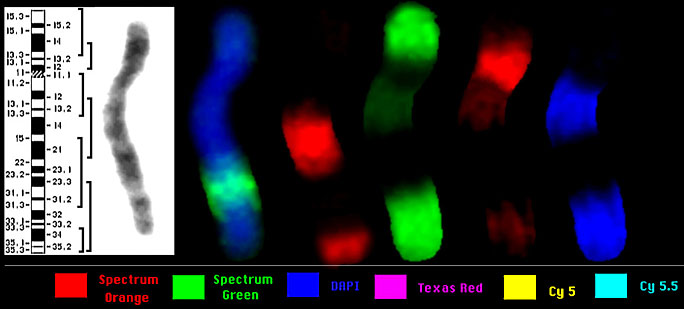
Рис. 6. Микродиссекционные ДНК библиотеки хромосомы 5 человека.
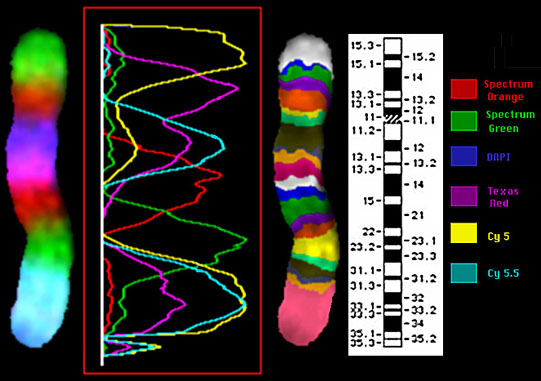
Рис. 7. Многоцветная исчерченность хромосомы 5 человека.
За предоставленные иллюстрации авторы выражают благодарность фирмам “MetaSystems GmbH” (рис. 3, 6, 7) и “Applied Imaging” (рис. 4, 5).
Н.Б.Рубцов, заведующий лабораторией морфологии и функции клеточных структур,